|
首例猪心脏移植者仅存活60天!柳叶刀公布失败原因,“异种器官移植”还有希望吗?时间:2023-07-05 09:47 2022年1月7日,57岁的大卫·贝内特(David )在美国马里兰大学医学中心(UMMC)接受了全球首例猪心脏移植手术。历经 7 小时,一颗经过基因编辑的猪心脏在他体内重新跳动起来。然而两个月后的3月8日,大卫·贝内特便去世了。当时院方并没有公布确切的死亡原因,全球首例移植猪心脏者死亡,让人无比惋惜,人们对其死亡原因也充满了疑问。 只存活60天,柳叶刀公布失败原因 2023年6月30日,据马里兰大学网站报道,著名医学杂志《柳叶刀》发表一项研究,揭示了世界首例转基因猪心移植失败的可能原因。
▲全球首例猪心移植人类手术(图片来源:马里兰大学医学院网站) 马里兰大学医学院外科学教授、心脏异种移植项目主任穆罕默德·毛希丁,猪心脏移植手术医生巴特利·格里菲思是该研究的主要作者。据《柳叶刀》发布的这项新研究证实,可能有多种原因叠加导致了患者的心力衰竭。首先,患者在移植前健康状况不佳,导致他的免疫系统严重受损,这也限制了移植临床前研究中使用的有效抗排斥方案的使用。研究人员发现,因此,患者的器官可能更容易受到免疫系统产生的抗体的排斥。然后,患者在移植后使用静脉注射免疫球蛋白(IVIG)(一种含有抗体的药物)也可能导致心肌细胞受损。在移植后的第二个月,患者接受了两次注射,以帮助预防感染,也可能引发对猪心的免疫反应。最后,这项新研究认为,猪心脏中可能存在一种名为猪巨细胞病毒(PCMV)的潜伏病毒,这可能导致移植功能障碍。在患者减少抗病毒治疗方案后,病毒可能被激活,引发了导致细胞损伤的炎症反应。然而,没有证据表明该病毒感染了患者或扩散到心脏以外的器官。 格里菲思表示:“我们希望下一位患者不仅能够通过移植存活更长时间,而且能够恢复正常生活数月甚至数年。”虽然首位异体移植患者不幸去世,但在人类器官供应紧张的现实面前,这次手术仍给异种器官移植带来了新的想象空间。 异种器官移植能否复兴 器官移植主要有两个分支,一种是“同种异体器官移植”,也就是接受器官移植的受体和供体是同一种类,比如人与人之间的器官移植;还有一种是“异种器官移植”,比如将动物的器官移植到人体中。目前,在临床上进行的器官移植手术,绝大多数是同种异体器官移植,但由于供体数量不足,很多人到生命的最后一刻也无法等到适合的器官。 据专家估算,我国每年需要进行器官移植来挽救生命的患者大约有 30 万。2020 年,我国器官供体与受体的比例为 1∶15。每15 个等待的患者有一个可以获得救命的器官,状况虽有缓解,但仍有大量患者在等待中离去。为缓解器官移植严重“供不应求”的矛盾,科学家们很早开始尝试动物器官替代的方法,开展异种器官移植也成为世界公认解决器官短缺的重要途径。哪些动物能够担当器官移植的供体呢?人们最先想到的是与人类亲缘关系密切的猴、猩猩和狒狒。它们与人类同属于灵长类,器官结构、生理功能、新陈代谢与人类相似。
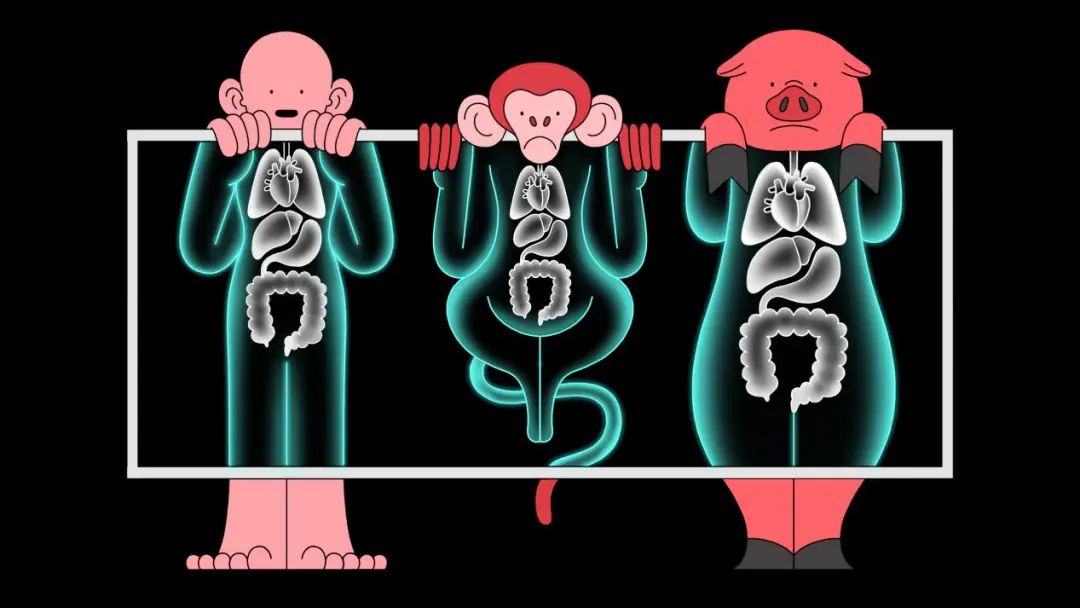
▲X 光机下人、猴、猪的图解(图片来源:视觉中国) 早在 20 世纪 60 年代,外科医生曾试图将猩猩的器官移植到人类身上。受体免疫系统很快对移植的器官产生了排斥,导致移植器官在短时间内发生功能衰竭,从而导致接受器官移植者的死亡。初期探索的反复失败,让人们意识到,灵长类的“近亲”们可能并不是理想的器官移植供体。而将灵长类列为器官供体候选者也面临着包括技术、伦理在内的诸多问题。 灵长类中大多数体型较小的种类,其器官性能和尺寸又无法承担人类代谢的需要;灵长类繁殖率较低,且体型较大的猩猩和狒狒,本身处于濒危状态,也难以满足人类对器官移植数量的需求。与人类是“近亲”的它们,还可能带有一些人类易感染的病毒,如猴免疫缺陷病毒和埃博拉病毒等,一旦这些器官移植到人体上,发生重组后可能产生更有害的病毒。种种的不利因素,使得灵长类候选者们的“光环”暗淡下来。科学家们又将目光转到了体型、食性、代谢水平等外在指标与人类接近的动物身上。经过层层“筛选”,因器官大小与人类相仿,传染病风险较低,数量相对更为充足等优势,猪被认为是现阶段异种器官移植的最佳选择对象。 从性能参数来看,猪与人的体温均为 36℃~ 37℃,心脏大小、管道分布和动力输出,甚至心率(人的心率为 60 ~ 100 次 / 分钟,猪为55~60次/分钟)都相类似。可预见的器官移植范围包括角膜、皮肤、胰岛、关节、肌腱、韧带、肾脏、心脏、肝脏等多方面。在医学界,植入人体细胞的猪的心脏瓣膜已经用于患者治疗,猪的韧带肌腱移植也已经成熟。 2017 年 9 月,在美国巴尔的摩召开的第 14 届国际异种移植协会大会上,亚特兰大埃默里大学团队宣布他们实验室的一只猕猴接受了基因改造过的猪肾脏的移植后400多天才发生排斥反应,比此前记录延长了数个月。德国慕尼黑大学团队在狒狒身上进行了猪心脏移植,移植物坚持了 90 天。
▲德国的研究人员给多只狒狒从猪身上移植心脏,狒狒存活了90 天(图片来源:) 同时,小部分生物工程公司利用基因编辑技术,通过敲除部分猪的基因和插入人类基因提高了异种器官与人体免疫相容性,并降低了动物内源性病毒的传染风险。 基因技术破解部分阻碍 即使面临的问题还有很多,但在基因编辑技术的加持下,异种器官移植似乎为患者们推开了一扇窗。所有器官移植都要面临的主要障碍,在于人类自身免疫系统“清除异己”的行为。一旦有“外来物”进入人体,免疫系统就会对“外来物”发起攻击和排斥,几分钟内移植的器官就可能被摧毁。这种超急性的排斥反应,不仅出现在异种器官移植中,在人与人之间的器官移植中也难以避免。 为应对超急性排斥反应,科学家曾试图通过清除供体的抗原,或利用血液透析去掉受体体内的抗体等方式进行动物实验,但这些方法收效甚微。随着基因技术的发展,尤其是基因编辑技术/Cas9 的出现,科学家可以“敲除”某种基因实现更匹配的器官移植供体。 同时,研究人员也向猪体内添加人类基因,让猪器官移植到人体内后,可产生正常运作的蛋白质,如能抑制血液凝固的人血栓调节蛋白,能使器官免受宿主抗体免疫应答攻击的 CD46。异种器官移植潜在的病毒传播风险是相当棘手的。目前研究确定有 26 种存在种间交叉感染风险的病原体,其中包括猪内源性逆转录病毒(PERV)。 虽然目前没有关于 PERV 在人体内致病的相关报道,但 PERV 仍是全球监管机构主要担忧的问题之一。不能因异体器官移植“搞出”新的病毒传播。为打消忧虑,科学家再次使用基因“敲除”的方法,实现了一次性敲除隐藏在基因组中的 PERV 片段,病毒感染率降到原来的千分之一。
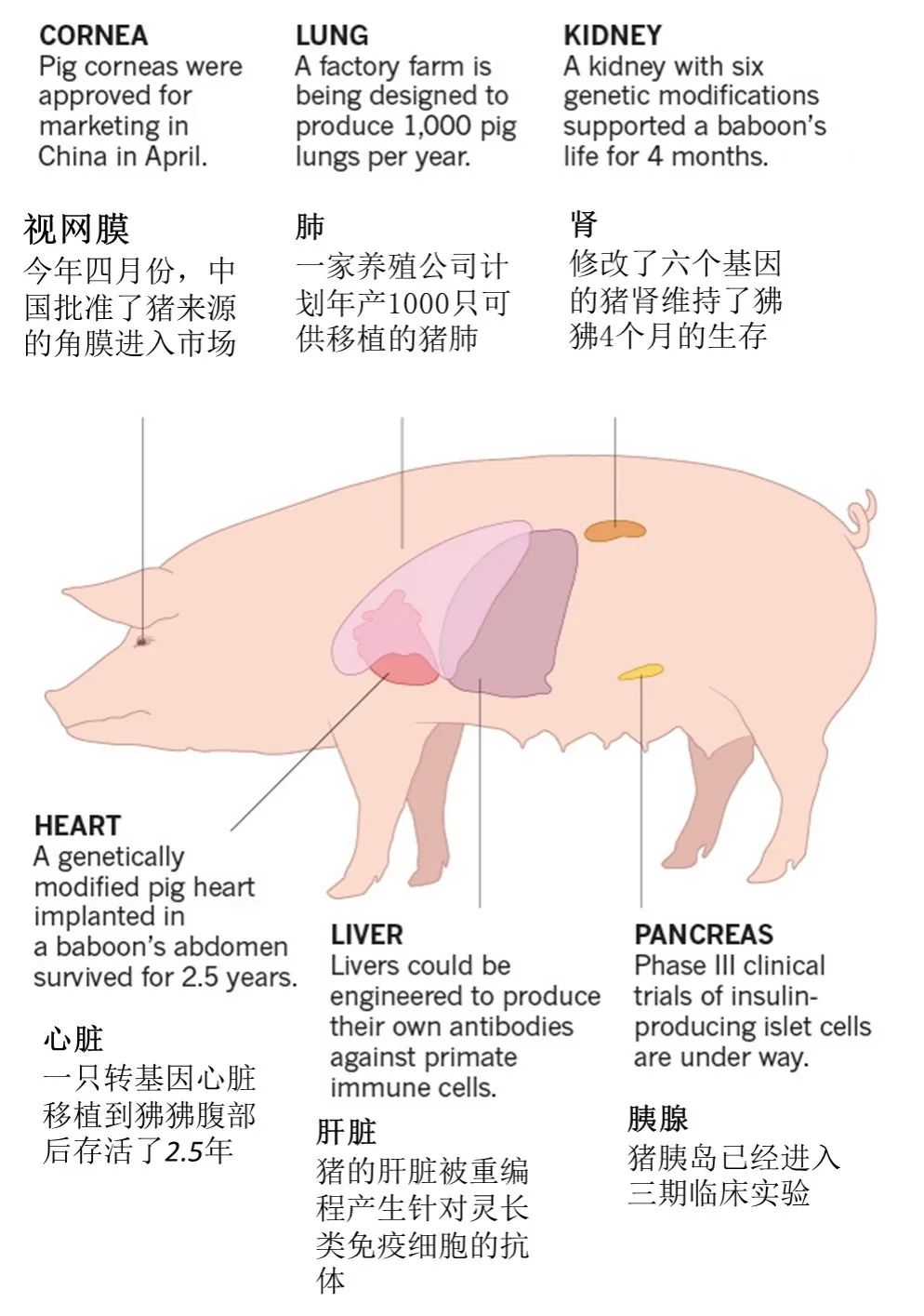
▲一头猪的器官可广泛用于人体角膜、皮肤、胰岛、关节、肌腱、韧带、肾脏、心脏、肝脏等器官的移植(图片来源:) 2017 年,哈佛大学教授乔治·丘奇和杨璐菡团队在《科学》杂志发表了研究成果。他们培育出了世界上首批不带内源性逆转录病毒的猪,从根本上解决了猪器官移植至人体可能导致病毒传染的风险。第二年,进一步解决异种器官移植免疫排斥问题的 2.0版转基因猪诞生。此后,结合前两代优势的 3.0 版转基因猪,在异种器官移植的安全性和有效性上更进一步。
▲杨璐菡团队进行基因编辑改造的“猪3.0”(图片来源:) 通过已知的猪和人的免疫系统关键的基因位点,科学家都能利用基因编辑来解决。开篇提到的全球首例猪心脏移植到人体手术中用到的猪心脏,就经过了 10 个基因修改,包括敲除 1 个控制器官生长的基因,3 个人类免疫排斥的基因,同时插入了 6 个使猪心脏可以更好地适应人体免疫系统的基因。当然,为了得到这样的理想中的器官移植供体,它们的生活环境有必要保持完全无菌、无病毒的“隔绝”状态。可以想象,在一个超洁净的猪舍内,身上配有电子芯片的它们,被 24 小时地监控,吃着经过无菌无毒处理的饲料和水,按时接受检疫检验……所有这一切必然需要大量的财力、物力投入。 绕不开的伦理挑战 当然,从解决器官移植“供不应求”矛盾的角度出发,技术和金钱的难题应该都是可解的。那么关于伦理的争议又该如何面对呢?移植猪器官的人类算不算是“混合体”? 关于这一问题,南京医科大学的戴一凡教授曾以个人角度回应,他认为,“就像汽车换了发动机,还是原来那个牌子的汽车,本质没发生变化。如果说人换上猪心脏就成了猪人,那么体内装上人工装置的患者就成机器人了吗?”动物器官的记忆会不会移植给人?临床实验中,移植年轻人肾脏的长者,头发会变黑,移植脾气暴躁者的心脏,温和的人脾气变得暴躁……如果器官真的有“记忆”,那么异种器官会对人的生理和心理产生怎样的影响?
▲像生产肉肠那样“生产”器官以供给人类进行移植!这并非是天方夜谭,那些科幻片中的情节正在成为现实(图片来源:) 此外,不同动物寿命也不一样。一般猪的寿命在 15 年左右,那么移植猪器官是不是会加速受体的老化呢?关于异种器官移植的基因编辑的最大限度在哪里?动物器官具备了一定比例的人类细胞,那该称呼“它”还是“他”? (文章来源:综合自羊城晚报、环球网、界面新闻、知识分子知乎专栏、科学公会知乎专栏、新华网) |